Hiện nay có rất nhiều các bạn học sinh không nhớ được hiệu suất phản ứng là gì và công thức tính hiệu suất phản ứng như thế nào? Chính vì vậy, Hyundai Smart Phone sẽ chia sẻ các công thức tính hiệu suất phản ứng hóa học kèm theo các bài tập có lời giải chi tiết để các bạn cùng tham khảo nhé
Hiệu suất phản ứng là gì?
Hiệu suất phản ứng trong hóa học là lượng sản phẩm tối đa (sản phẩm thực tế) mà một phản ứng hoá học có thể tạo ra. Ký hiệu là H. Đơn vị tính là: %
- Nếu H = 100% thì phản ứng xảy ra hoàn toàn hoặc là 1 chất phản ứng hết và còn 1 chất dư.
- Nếu H < 100% thì phản ứng xảy ra không hoàn toàn và các chất tham gia phản ứng còn dư
Công thức tính hiệu suất phản ứng
Hiệu suất phản ứng được tính bằng khối lượng thực tế nhân với 100%. Sau đó, chia cho khối lượng lý thuyết
H = (mtt x 100%)/mlt
Trong đó:
- H: hiệu suất phản ứng (%)
- mtt: khối lượng thực tế (g)
- mlt: khối lượng lý thuyết (tính theo phương trình) (g)
Công thức tính khối lượng chất tham gia khi có hiệu suất
Vì hiệu suất phản ứng thường nhỏ hơn 100%, do đó lượng sản phẩm ở thực tế thu được sẽ phải nhỏ hơn nhiều sự hao hụt. Sau khi khối lượng sản phẩm giống theo phương trình phản ứng, thì ta có thể tính được khối lượng sản phẩm khi có hiệu suất như sau:
mtt = (mlt x 100)/H
Công thức tính khối lượng sản phẩm khi có hiệu suất
Do hiệu suất phản ứng nhỏ hơn 100%, nên lượng sản phẩm thực tế thu được phải nhỏ hơn nhiều sự hao hụt. Sau khi khối lượng sản phẩm theo phương trình phản ứng, ta tính khối lượng sản phẩm khi có hiệu suất như sau:
mtt = (mlt x H )/100%
Công thức tính hiệu suất của phản ứng hoá học
Cho phản ứng hóa học: A + B → C
Hiệu suất phản ứng sẽ là:
H = số mol pứ . 100% / số mol ban đầu
hay có thể tính theo khối lượng như sau:
H = khối lượng thu được ở thực tế . 100% / khối lượng thu được tính theo phương trình
Lưu ý là tính hiệu suất theo số mol chất thiếu (theo số mol nhỏ)
Từ công thức cũng có thể tính được:
- nC = nA pứ = (nAbđ . H)/100
- nA bđ cần dùng: nAbđ = (nC.100)/H
Tham khảo thêm: Công thức tính số mol, Nồng độ mol, Nồng độ phần trăm chính xác 100%
Công thức tính hiệu suất phần trăm của phản ứng
Hiệu suất phần trăm của phản ứng được tính theo công thức như sau:
H% = (lượng tt/ lượng lt) x 100.
Còn độ hao phí của phản ứng thì cần phải dựa theo phần trăm được tính theo công thức:
%hao phí = 100% – %hiệu suất.
Và sai số của phản ứng được tính bằng công thức:
Sai số pư = Lượng lý thuyết – lượng thực tế.
Công thức tính hiệu suất vật lý
Công thức tính hiệu suất thực chất là việc tìm ra tỉ số giữa công có ích so với công toàn phần (là tổng công có ích và công hao phí).
H = A1/A
Trong đó:
- H là hiệu suất
- A1 là công có ích
- A là công toàn phần
Lưu ý: Nếu công hao phí càng bé thì hiệu suất sử dụng sẽ càng lớn.
Bài tập về tính hiệu suất phản ứng có lời giải
Ví dụ 1: Người ta nung 15 g CaCO3 thu được 6,72 g CaO và một lượng khí CO2. Tính hiệu suất phản ứng.
Lời giải
nCaCO3= 0,15 mol, nCaO = 0,12 mol
Phương trình phản ứng:
CaCO3 t0→ CaO + CO2
0,15 → 0,15 (mol)
Khối lượng CaO thu được theo lý thuyết là mlt = mCaO = 0,15. 56 = 8,4 g
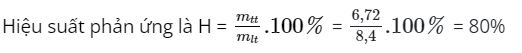
Ví dụ 2: Cho 19,5 gam Zn phản ứng với 7 (lít) clo thì thu được 36,72 gam ZnCl2. Tính hiệu suất của phản ứng?
Lời giải
nZn = 19,5/65 = 0,3 (mol)
nCl2 = 7/22,4 = 0,3125 (mol)
nZnCl2 = 0,27 (mol)
Phương trình hóa học
Zn + Cl2 → ZnCl2
Ta thấy:
nCl2 > nZn ⇒ so với Cl2 thì Zn là chất thiếu, nên ta sẽ tính theo Zn.
Từ phương trình ⇒ nZn phản ứng = nZnCl2 = 0,27 (mol)
Hiệu suất phản ứng:
H = số mol Zn phản ứng .100/ số mol Zn ban đầu = (0,27 . 100)/0,3 = 90 %
Ví dụ 3: Người ta nung 4,9 gam KClO3 có xúc tác thu được 2,5 gam KCl và một lượng khí oxi.
a. Viết phương trình hóa học xảy ra.
b. Tính hiệu suất của phản ứng
Lời giải
a. Phương trình hóa học: 2KClO3 t0→ 2KCl + 3O2↑
2KClO3 t0→ 2KCl + 3O2↑
1 → 1 mol
0,04 → 0,04 (mol)
Khối lượng KCl thu được theo lý thuyết là:
mlt = mKCl= nKCl.MKCl= 0,04.74,5 = 2,98 gam
Hiệu suất của phản ứng là
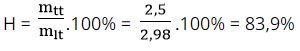
Ví dụ 4: Để điều chế 8,775 g muối natri clorua (NaCl) thì cần bao nhiêu gam natri và bao nhiêu lít clo (đktc), biết hiệu suất phản ứng = 75%.
Lời giải
nNaCl = 0,15 mol
Phương trình phản ứng
2Na + Cl2 t0→ 2NaCl
2 1 2
0,15 0,075 0,15
Khối lượng Na và thể tích khí clo theo lý thuyết:
mNalt = nNa.MNa = 0,15.23 = 3,45 (gam)
VCl2 = nCl2.22,4 = 0,075.22,4 = 1,68 lít
Khi có H = 75%, khối lượng Na và thể tích khí clo thực tế là:
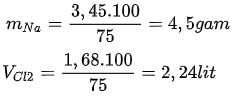
Ví dụ 5: Cho 21,75g MnO2 tác dụng hết axit HCl đặc
a) Tính V của Cl2tạo thành ở đktc, H = 80%
b) Clo ở trên tác dụng hết với Fe (đun nóng). Tính lượng muối tạo thành
c) Xác định M (hóa trị 2) biết clo tác dụng vừa đủ 4,8g kim loại M
Lời giải
a. Phương trình hóa học
MnO2 + 4HCl → MnCl2 + Cl2+ 2H2O
Ta có:
nCl2 lt = nMnO2 = 21,75/(55 +16.2) = 0,25 mol
⇒ nCl2 = 0,25.80% = 0,2 mol
⇒ VCl2 = 0,2.22,4 = 4,48 lít
b. Phương trình hóa học:
2Fe + 3Cl2 → 2FeCl3
⇒ nFeCl3 = 2/3nCl2 = 0,4/3 mol
⇒ mFeCl3 = 0,4/3.(56 + 35,5.3) = 21,67 gam
c. M + Cl2 → MCl2
⇒ nM = nCl2 = 0,2 mol
⇒ MM = 4,8/0,2 = 24
Vậy M là Mg
Ví dụ 6: Cho 13,6 gam hỗn hợp X gồm axit axetic (CH3COOH) và rượu etylic (C2H5OH) được trộn theo tỉ lệ mol tương ứng là 3 : 2. Đun nóng X với H2SO4 đặc một thời gian thu được m gam este CH3COOCH2CH3 với hiệu suất phản ứng là 80%. Giá trị của m là bao nhiêu?
Lời giải
Gọi số mol của CH3COOH là 3a mol → số mol của CH3CH2OH là 2a mol
mX = 13,6 gam → 60.3a + 46.2a = 13,6 → a = 0,05 mol
Phương trình hóa học:
CH3COOH + CH3CH2OH xt→ CH3COOCH2CH3 + H2O
0,15 → 0,1 → mol
Giả sử hiệu suất là 100% thì rượu etylic hết, nên số mol sản phẩm phản ứng tính theo số mol rượu etylic.
neste lt = nrượu = 0,1 mol

Ví dụ 7: Có 12 lít hỗn hợp 2 khí Cl2 và H2 đựng trong bình đậy kín. Chiếu sáng để phản ứng xảy ra thì thu được 1 hỗn hợp khí chứa 30% V là khí sản phẩm, lượng Cl2 còn 20% so với ban đầu (các V đo ở cùng nhiệt độ và áp suất)
a) Tính % V của hỗn hợp trước và sau phản ứng.
b) Tính hiệu suất của phản ứng.
Lời giải
Gọi x, y là thể tích H2, Cl2
Trong hỗn hợp X ban đầu
⇒ x + y = 12
Gọi a là thể tích phản ứng:
H2 + Cl2 → 2 HCl
a a 2a
Phản ứng không thay đổi thể tích
⇒ Hỗn hợp Y sau phản ứng vẫn có thể tích = 12 lít
⇒ VHCl = 2a = 12.0,3 => a = 1,8
Thể tích Cl2 sau phàn ứng = y – a = 0,8y
⇒ y = 4a = 7,2
⇒ x = 4,8
⇒ Nếu phản ứng hoàn toàn ⇒ H2 hết
⇒ Hiệu suất đối với H2 = 1,8.100/4,8 = 37,5%
Ví dụ 8: Từ 3 tấn quặng pirit (chứa 585 FeS2 về khối lượng, phần còn lại là các tập chất trơ) điều chế được bao nhiêu tấn dung dịch H2SO4 98%, hiệu suất chung của có quá trình điều chế là 70%.
Lời giải
Phương trình phản ứng hóa học xảy ra
4 FeS2+ 11O2 → 2 Fe2O3 + 8 SO2
SO2+ 1/2 O2→ SO3
SO3 + H2O → H2SO4
mFeS2 = 0,58. 3=1,74(tấn)
m(H2SO4, lí thuyết)= (98.1,74)/ 480 = 0,35525 (tấn)
Vì hiệu suất quá trình điều chế là 70%
Khối lượng H2SO4 thực tế thu được là:
mH2SO4(TT) = 0,35525.70% = 0,248675 (tấn)
Khối lượng dung dịch H2SO4 98% là
⇒ mddH2SO4 = (0,248675.100)/98 = 0,25375(tấn) = 253,75 (kg)
Hy vọng với những thông tin mà chúng tôi vừa chia sẻ có thể giúp các bạn nắm được công thức tính hiệu suất phản ứng hóa học để vận dụng vào làm bài tập nhé.