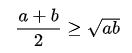Trong phần Hóa học hôm nay, Hyundai Smart Phone sẽ hướng dẫn các bạn lý thuyết cấu hình electron nguyên tử là gì và cách viết cấu hình electron nguyên tử kèm theo các dạng bài tập có lời giải chi tiết nhất để các bạn hệ thống lại kiến thức của mình
Cấu hình electron nguyên tử là gì?
Cấu hình electron nguyên tử biểu diễn sự phân bố electron trên các phân lớp thuộc các lớp khác nhau.
Quy tắc viết cấu hình electron nguyên tử
Số thứ tự lớp electron được viết bằng các chữ số (1, 2, 3 …)
Phân lớp được kí hiệu bằng chữ cái thường (s, p, d, f)
Số electron được ghi bằng chỉ số ở phía trên, bên phải kí hiệu của phân lớp (s2; p6 …)
Cách viết cấu hình electron nguyên tử
Để viết cấu hình electron nguyên tử thì bạn cần dựa vào nguyên lý vững bền, nguyên lý Pauli và quy tắc Hund:
- Nguyên lý Pauli: Trên một obital nguyên tử chỉ có thể chứa tối đa là hai electron và hai electron này chuyển động tự quay khác chiều nhau xung quanh trục riêng của mỗi electron.
- Quy tắc Hund: Trong cùng một phân lớp, các electron sẽ phân bố trên các obital sao cho số electron độc thân là tối đa và các electron này phải có chiều tự quay giống nhau.
- Nguyên lý vững bền: Ở trạng thái cơ bản, trong nguyên tử các electron lần lượt chiếm các obital có mức năng lượng từ thấp đến cao
Các bước viết cấu hình electron nguyên tử
- Bước 1: Xác định số electron của nguyên tử (chú ý trong nguyên tử số electron = số proton = số hiệu nguyên tử = số thứ thự ô nguyên tố).
- Bước 2: Điền electron theo thứ tự các mức năng lượng từ thấp đến cao (dãy Klechkovski) theo các nguyên lý và quy tắc phân bố electron trong nguyên tử: 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s …
- Bước 3. Viết cấu hình electron biểu diễn sự phân bố electron trên các phân lớp thuộc các lớp khác nhau.
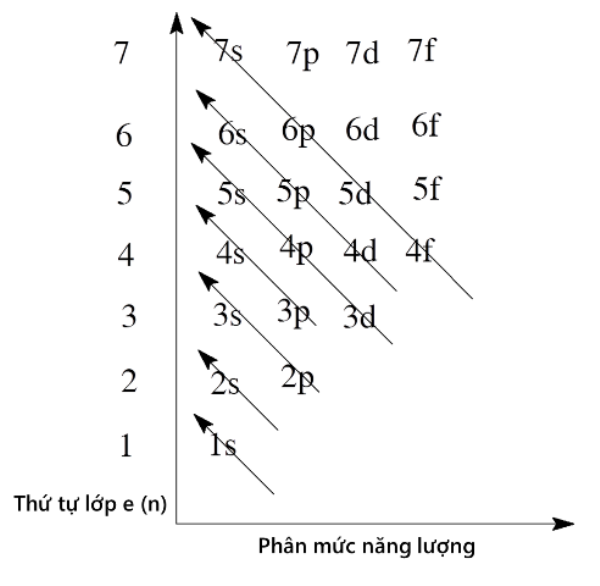
Ví dụ: 26Fe.
Có 26e
Viết theo trật tự mức năng lượng AO tăng dần:
1s2 2s2 2p6 3s2 3p6 4s2 3d6
Sau đó viết lại theo thứ tự các phân lớp electron trong 1 lớp:
1s2 2s2 2p6 3s2 3p6 3d6 4s2
Viết gọn: [Ar] 3d6 4s2
* Chú ý:
+ Trật tự các mức năng lượng AO tăng dần như sau:
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p
+ Dạng (n – 1)d4ns2 chuyển thành (n – 1)d5ns1
(n – 1)d9ns2 chuyển thành (n – 1)d10ns1
* Dựa vào số electron ở lớp ngoài cùng để suy ra tính chất của nguyên tố hóa học.
| Số electron lớp ngoài cùng | Tính chất của nguyên tố |
| 1, 2, 3 | Kim loại |
| 4 | Kim loại hoặc phi kim |
| 5, 6, 7 | Phi kim |
| 8 | Khí hiếm |
Sơ đồ hình thành ion nguyên tử:
M → Mn+ + ne
X + me → Xm-
Cách viết cấu hình electron của ion
Từ cấu hình electron của nguyên tử suy ra cấu hình electron của ion tương ứng.
Cấu hình electron cùa ion dương: bớt đi số electron ở phân lớp ngoài cùng của nguyên tử đúng bằng điện tích ion (nếu số electron phải bớt đi lớn hơn số electron ở phân lớp ngoài cùng, tiếp tục bớt electron ở phân lớp tiếp theo)
Ví dụ: Cấu hình electron của Fe (Z = 26) [Ar]3d64s2
⇒ Cấu hình electron của Fe2+: [Ar]3d6
⇒ Cấu hình electron của Fe3+: [Ar]3d5
Cấu hình electron của ion âm: nhận thêm số electron bằng đúng điện tích của ion đó vào phân lớp ngoài cùng của nguyên tử.
Ví dụ: Cấu hình electron của Cl (Z = 17): [Ne]3s23p5
⇒ Cấu hình electron của CL-: [Ne]3s23p6
Tham khảo thêm:
- Lý thuyết dãy hoạt dộng hóa học của kim loại và bài tập chuẩn 100%
- Cách tính hóa trị của nguyên tố và bài tập có lời giải từ A – Z
- Công thức tính số mol, Nồng độ mol, Nồng độ phần trăm chính xác 100%
Bài tập về cách viết cấu hình Electron có đáp án chi tiết nhất
Ví dụ 1: Cho biết số electron tối đa trong 1 lớp, 1 phân lớp
Lời giải:
Số electron tối đa trong một phân lớp
- Phân lớp s chứa tối đa 2e
- Phân lớp p chứa tối đa 6e
- Phân lớp d chứa tối đa 10e
- Phân lớp f chứa tối đa 14e
Số electron tối đa trong một lớp
- Lớp thứ nhất có tối đa 2e
- Lớp thứ hai có tối đa 8e
- Lớp thứ ba có tối đa 18e
Ví dụ 2: Một nguyên tử của nguyên tố X có 3 lớp electron. Lớp ngoài cùng có 4 electron. Xác định số hiệu nguyên tử của X. Viết cấu hình e của X
Lời giải:
Z = 2 + 8 + 4 = 14
Cấu hình e của X là 1s22s2p63s23p2
Ví dụ 3: Một nguyên tố d có 4 lớp electron, phân lớp ngoài cùng đã bão hòa electron. Tổng số electron s và electron p của nguyên tố này là
Lời giải:
Nguyên tố d có 4 lớp electron → electron cuối cùng trên phân lớp 3d.
Cấu hình electron của nguyên tố này có dạng: 1s22s22p63s23p63dX4s2.
Vậy tổng số electron s và electron p là 20
Ví dụ 4: Nguyên tử X có ký hiệu 2656X. Cho các phát biểu sau về X:
(1) Nguyên tử của nguyên tố X có 8 electron ở lớp ngoài cùng.
(2) Nguyên tử của nguyên tố X có 30 nơtron trong hạt nhân.
(3) X là một phi kim.
(4) X là nguyên tố d.
Trong các phát biểu trên, những phát biểu đúng là?
A. (1), (2), (3) và (4).
B. (1), (2) và (4).
C. (2) và (4).
D. (2), (3) và (4).
Lời giải:
Do có sự chèn mức NL nên electron được phân bố như sau:
1s22s22p63s23p6 4s23d6
Cấu hình electron của X: 1s22s22p63s23p63d64s2hay [Ar] 3d64s2
– Số e lớp ngoài cùng là 2 do đó X là Kim loại
– N = A – Z = 56 – 26 = 30
– Electron cuối cùng phân bố trên phân lớp 3d nên X là nguyên tố d.
⇒ Chọn C.
Ví dụ 5: Nguyên tử của nguyên tố X có tổng số hạt electron trong các phân lớp p là 7. Số hạt mang điện của một nguyên tử Y nhiều hơn số hạt mang điện của một nguyên tử X là 8 hạt. Tìm các nguyên tố X và Y
Lời giải:
Nguyên tử của nguyên tố X có tổng số hạt electron tron các phân lớp p là 7
⇒ Cấu hình electron của nguyên tử X là: 1s2 2s2 2p6 3s2 3p1
⇒ ZX = 13 ⇒ X là Al
Số hạt mang điện cảu một nguyên tử Y nhiều hơn số hạt mang điên của một nguyên tử X là 8 hạt
⇒ 2ZY – 2ZX = 8
⇔ 2ZY – 2.13 = 8
⇒ ZY = 17 ⇒ Y là Cl
Ví dụ 6: Nguyên tử của nguyên tố X có electron ở mức năng lượng ở mức cao nhất là 3p. nguyên tử của nguyên tố Y cũng có electron ở mức năng lượng 3p và có một electron ở lớp ngoài cùng. Nguyên tử X va Y có số electron hơn kém nhau 3. Nguyên tử X, Y lần lượt là:
Cấu hình e của Y: [Ne] 3s2 3p1 ⇒ Y là kim loại
Ta có: ZY = 13 ⇒ ZX = 11 ⇒ Cấu hình: [Ne] 3s1 (loại)
⇒ ZX = 15⇒ Cấu hình: [Ne] 3s2 3p3 ⇒ X là phi kim
Ví dụ 7: Nguyên tố A có cấu hình electron lớp ngoài cùng là 4s1. Nguyên tố B có phân lớp cuối là 3p5. Viết cấu hình electron đầy đủ của A, B. Xác định tên A, B.
Lời giải:
Cấu hình electron của A và B:
Nguyên tố A có 3 trường hợp:
Không có electron ở 3d:
⇒ Cấu hình electron: 1s2 2s2 2p6 3s2 3p6 4s1: Z = 19 (K)
Có electon ở 3d: vì 4s1 chưa bão hòa nên:
hoặc 3d bán bão hòa: 1s2 2s2 2p6 3s2 3p6 3d5 4s1:Z = 24 (Cr)
hoặc 3d bão hòa: 1s2 2s2 2p6 3s2 3p6 3d10 4s1: Z = 29 (Cu)
Nguyên tố B: 1s2 2s2 2p6 3s2 3p5, B có Z = 17 là clo (Cl)
Ví dụ 8: Viết cấu hình electron của các ion Cu2+, N3-, Fe3+, Cl–,Al3+. Biết số thứ tự nguyên tố lần lượt là: Cu (Z = 29), N (Z = 7), Fe (Z = 26), Cl (Z = 17), Al (Z = 13).
Lời giải:
Đáp án:
Cu2+ = 1s2 2s2 2p6 3s2 3p6 3d9
N3- = 1s2 2s2 2p6
Fe3+ = 1s2 2s2 2p6 3s2 3p6 3d5
Cl– = 1s2 2s2 2p6 3s2 3p6
Al3+ = 1s2 2s2 2p6
Sau khi đọc xong bài viết của chúng tôi có thể giúp bạn biết cách viết cấu hình electron để vận dụng vào làm bài tập một cách nhanh chóng và chính xác nhất. Cảm ơn các bạn đã theo dõi bài viết của chúng tôi