Bạn có bài tập liên quan đến kim loại tác dụng với nước nhưng bạn lại không biết cách giải như thế nào? Sau đây, Hyundai Smart Phone sẽ chia sẻ lý thuyết kim loại tác dụng với nước kèm theo các bài tập minh họa có đáp án để các bạn cùng tham khảo
Lý thuyết kim loại tác dụng với nước
1. Nước có thể tác dụng với một số kim loại như K, Na, Ca, Ba… ở nhiệt độ thường tạo ra bazơ tương ứng và khí hiđro.
Kim loại + H2O → Bazơ + H2
Phương pháp giải:
- Bước 1: Tính số mol các chất đã cho.
- Bước 2: Viết phương trình hóa học, cân bằng phản ứng.
- Bước 3: Xác định chất dư, chất hết (nếu có), tính toán theo chất hết.
- Bước 4: Tính khối lượng hoặc thể tích các chất theo yêu cầu đề bài.
Ngoài ra, có thể áp dụng định luật bảo toàn khối lượng: mtham gia = msản phẩm
2. Kim loại tác dụng với nước – sau đó dung dịch tạo thành được trung hòa bằng dung dịch axit
H + + OH – → H2O
3. Kim loại tác dụng với nước – sau đó dung dịch tạo thành tác dụng với dung dịch muối.
Phương pháp giải
- Bước 1: Xác định phương trình hóa học xảy ra.
- Bước 2: Xử lí dữ liệu đề bài, tính toán theo phương trình hóa học, đặt ẩn (nếu cần).
- Bước 3: Tính toán theo yêu cầu của đề bài.
Tham khảo thêm:
- Lý thuyết dãy hoạt dộng hóa học của kim loại và bài tập chuẩn 100%
- NO2 ra HNO3: NO2 + O2 + H2O → HNO3 kèm ví dụ minh họa từ A – Z
- Cách xác định số oxi hóa của các nguyên tố kèm VD có đáp án
Bài tập về kim loại tác dụng với nước có đáp án
Ví dụ 1: Cho 1,24 g hỗn hợp Na và K tác dụng hết với nước, sau phản ứng thu được 1,92 gam hỗn hợp 2 bazơ NaOH và KOH. Thể tích khí H2 sinh ra ở đktc là bao nhiêu?
Lời giải
2Na + 2H 2 O → 2NaOH + H 2
x……………x……x/2…….mol
2K + 2H 2 O → 2KOH + H 2
y…………y……..y⁄2………..mol
Theo bài ra, ta có hệ phương trình:
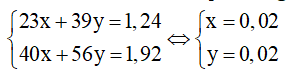
⇒ n H2 = x/2 + y/2 = 0,1+ 0,1 = 0,02 mol
⇒ V H2 = 0,02,22,4=0,448 mol
Ví dụ 2: Cho hỗn hợp Na, K, Ba tác dụng hết với nước, thu được dung dịch X và 3,36 lít khí H2 (đktc). Nếu cho X tác dụng hết với dung dịch Al(NO3)3 thì khối lượng kết tủa lớn nhất thu được là bao nhiêu.
Lời giải
Từ nhận xét của bài 7 ta có:
nOH- = 2nH2 = 2,3,36 / 22,4 = 0,3 mol
Cho X tác dụng với Al(NO3)3, đạt kết tủa lớn nhất khi Al(OH)3 tạo ra chưa bị hòa tan bởi các hidroxit kiềm, kiềm thổ trong X, khi đó:
Al 3+ + 3OH – → Al(OH) 3
⇒ n Al(OH)3 = 1⁄3 n OH- = 1⁄3 . 0,3 = 0,1 mol
⇒ m ↓ = m Al(OH)3 = 0,1,78 = 7,8g
Ví dụ 3: Cho hỗn hợp A gồm 2 kim loại kiềm tan hết trong nước tạo ra dung dịch B và thoát ra 0,12 mol H2. Thể tích dung dịch H2SO4 2Y cần trung hòa dung dịch B là bao nhiêu?
Lời giải
Quy đổi 2 kim loại kiềm là 1 kim loại trung bình Y. Khi đó:
2Ȳ + 2H 2 O → 2ȲOH + H 2
2Ȳ + 2H 2 SO 4 → Ȳ 2 SO 4 + H 2 O
Ta thấy:
n MOH = 2n H2 = 2,0,12 = 0,24 mol
⇒ n H2SO4 = 1⁄2 n YOH = 1⁄2 . 0,24 = 0,12 mol
⇒ V H2SO4 = 0,12/2 = 0,06 lít = 60ml
Ví dụ 4: Cho 10 gam một kim loại M, có hóa trị II tác dụng hết với nước thoát ra 5,6 lít khí (đktc). Kim loại M là gì?
Lời giải
Ta có nH2 = 5,6 : 22, 4 = 0,25mol
M + 2H 2 O → M(OH) 2 + H 2 ↑
0,25 0,25 mol
MM = 10 : 0,25 = 40 ⇒ M là canxi (Ca)
Ví dụ 5: Cho 1,83 gam hỗn hợp 2 kim loai Na và Ba tác dụng với một lượng nước dư, thấy thoát ra 0,448 lít khí H2 đktc. Tổng khối lượng bazơ sinh ra là bao nhiêu?
Lời giải
n H2 = 0,448/22,4 = 0,02 mol
Cần nhớ rằng kim loại kiềm tác dụng với nước thì:
nOH trong bazo = 2.nH2 = 2.0,02 = 0,04 mol
mbazo = mkim loại + mOH = 1,83 + 0,04.17 = 2,51 g.
Ví dụ 6: Cho một hỗn hợp kim loại Na-Ba tác dụng với nước dư, thu được dung dịch X và 3,36l H2 (đktc). Thể tích dung dịch axit HCl 2M cần dùng để trung hòa dung dịch X là bao nhiêu?
Lời giải
2Na + 2H 2 O → 2NaOH + H 2
Ba + 2H 2 O → Ba(OH) 2 + H 2
Từ 2 phương trình trên ta có nhận xét:
nOH- = 2nH2 = 2,33,6 / 22,4 = 0,15 mol
Mà: OH- + H+ → H2O
⇒ nOH- = nH+ = 0,15 mol = nHCl
⇒ VHCl = 0,15/2 = 0,075 lit = 75ml
Ví dụ 7: Cho 0,85 g hỗn hợp 2 kim loại Na và K tác dụng hết với nước, sau phản ứng thu được 0,336 lít khí H2 (đktc). Thành phần phần trăm của Na và K trong hỗn hợp lần lượt là bao nhiêu?
Lời giải
2Na + 2H 2 O → 2NaOH + H 2
x x x/2 mol
K + 2H 2 O → 2KOH + H 2
x y y/2 mol
Theo bài ra, ta có hệ phương trình:
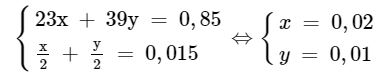
⇒m Na = 0,02,23 = 0,46g
%m Na = (0,46 : 0,85).100% = 54,1%
%m K = 100% – 54,1% = 45,9%
Ví dụ 8: Cho 1,67 gam hỗn hợp gồm hai kim loại ở 2 chu kỳ liên tiếp thuộc nhóm IIA tác dụng hết với H2O (dư), thoát ra 0,672 lít khí H2 (ở đktc). Hai kim loại đó là 2 kim loại nào?(cho Be = 9, Mg = 24, Ca = 40, Sr = 87, Ba = 137)
Lời giải
n H2 = 0,672/22,4 = 0,03 mol
Vì cả 2 kim loại ở 2 chu kỳ liên tiếp, cùng là kim loại nhóm IIA nên ta quy đổi 2 kim loại thành 1 kim loại trung bình, ta có phương trình:
M + 2H 2 O → M(OH) 2 + H 2
⇒ nH2 = nM(kim loại) = 0,03 mol
M = 1,67/0,03 = 55,67 gam
⇒ 2 kim loại cần tìm là Ca và Sr.
Bên trên chính là toàn bộ lý thuyết về kim loại tác dụng với nước kèm theo bài tập mà chúng tôi đã phân tích chi tiết có thể giúp bạn hệ thống lại kiến thức của mình để áp dụng vào làm bài tập. Hãy thường xuyên theo dõi chúng tôi để được chia sẻ thông tin khác