Nếu bạn học kém môn Hóa sẽ không biết cân bằng hoặc điều chế no2 ra hno3 như thế nào? Chính vì vậy, Hyundai Smart Phone sẽ cung cấp đầy đủ thông tin về phương trình hóa học đã được cân bằng, điều kiện các chất tham gia phản ứng, hiện tượng (nếu có) chi tiết trong bài viết dưới đây
Tính chất hóa học của phản ứng NO2 + O2 + H2O → HNO3
Phương trình phản ứng NO2 ra HNO3: 4NO2+ O2 + 2H2O → 4HNO3
Phản ứng hóa học trên là phản ứng oxi hóa khí NO2 bằng khí O2 trong môi trường nước tạo thành axit nitric HNO3. Đây là một phản ứng trung gian trong quá trình sản xuất axit nitric, một chất hóa học được sử dụng rộng rãi trong các ngành công nghiệp như sản xuất phân bón, thuốc nổ, các sản phẩm hóa học và trong các ứng dụng y tế.
Phản ứng xảy ra theo phương trình hóa học sau: NO2 + O2 + H2O → HNO3
Phản ứng này có tính chất exothermic, tức là có sự giải phóng nhiệt. Nhiệt lượng giải phóng trong quá trình phản ứng này có thể được sử dụng để cung cấp năng lượng cho quá trình sản xuất axit nitric.
Điều kiện xảy ra phản ứng NO2 + O2 + H2O → HNO3
Phản ứng NO2 + O2 + H2O → HNO3 là phản ứng hóa học quan trọng trong việc sản xuất axit nitric. Để xảy ra phản ứng này, cần có sự hiện diện của các chất khí NO2, O2 và nước.
Điều kiện xảy ra phản ứng:
- Nhiệt độ: Phản ứng này thường được thực hiện ở nhiệt độ cao. Nhiệt độ thường nằm trong khoảng từ 400°C đến 800°C.
- Áp suất: Áp suất cũng có thể ảnh hưởng đến tốc độ và hiệu suất phản ứng. Thông thường, phản ứng này thực hiện ở áp suất cao.
- Sự có mặt của xúc tác: Đôi khi, phản ứng này được thực hiện với sự có mặt của xúc tác, như platina (Pt) hoặc vanadium(V) pentoxide (V2O5), để tăng tốc độ phản ứng và cải thiện hiệu suất.
Lưu ý: phản ứng này thường được thực hiện trong điều kiện công nghiệp và yêu cầu thiết bị và quy trình đặc biệt để đảm bảo hiệu suất và an toàn.
Xem ngay: Hiệu suất phản ứng là gì? Công thức tính hiệu suất phản ứng hóa học có VD
Ứng dụng của phản ứng NO2 + O2 + H2O → HNO3
Phản ứng 4NO2 + O2 + 2H2O → 4HNO3 là phản ứng chuyển đổi khí nitơ dioxide (NO2), khí oxi (O2), và nước (H2O) thành axit nitric (HNO3). Axit nitric có nhiều ứng dụng thực tế quan trọng trong các lĩnh vực khác nhau như công nghiệp, nông nghiệp, y học và nhiều ứng dụng khác. Cụ thể:
1. Sản xuất axit nitric
Phản ứng NO2 + O2 + H2O → HNO3 là một phản ứng chính để sản xuất axit nitric, một chất hóa học quan trọng có nhiều ứng dụng trong ngành công nghiệp. Axit nitric được sử dụng để sản xuất phân bón, thuốc nổ, thuốc trừ sâu và thuốc nhuộm. Bên cạnh đó, nó cũng được sử dụng làm chất tẩy, chất oxy hóa và tác nhân trung gian trong quá trình sản xuất các sản phẩm hóa học khác.
2. Xử lý khí thải
NO2 là một trong những chất gây ô nhiễm môi trường và có thể gây hại cho sức khỏe con người. Phản ứng NO2 + O2 + H2O → HNO3 có thể được sử dụng để giảm thiểu khí thải độc hại.
Phản ứng này có thể chuyển đổi NO2 thành HNO3, một chất hóa học không gây ô nhiễm và có thể được tái sử dụng. Vì vậy, phản ứng này có thể được sử dụng để xử lý khí thải trong các nhà máy sản xuất axit nitric và giảm thiểu khí thải gây ô nhiễm trong môi trường.
3. Nghiên cứu khoa học
Phản ứng NO2 + O2 + H2O → HNO3 cũng được sử dụng trong nghiên cứu khoa học để tạo ra các mẫu axit nitric tinh khiết để sử dụng trong các phân tích hóa học và sinh học. Sản phẩm của phản ứng này có thể được sử dụng trong các phản ứng hóa học khác và trong các quá trình sản xuất khác.
Tham khảo thêm: Công thức tính số mol, Nồng độ mol, Nồng độ phần trăm chính xác 100%
Bài tập phản ứng NO2 ra HNO3: 4NO2+ O2 + 2H2O → 4HNO3
Ví dụ 1: Đem nung hỗn hợp A gồm: x mol Fe và 0,15 mol Cu, trong không khí một thời gian, thu được 63,2 gam hỗn hợp B, gồm hai kim loại trên và hỗn hợp các oxit của chúng. Đem hòa tan hết lượng hỗn hợp B trên bằng dung dịch HNO3 đậm đặc, thì thu được 0,6 mol NO2. Trị số của x là bao nhiêu?
Lời giải
Ta có: nO = y mol; nFe = x mol
56x + 0,15.64 + 16y = 63,2 (1);
3x + 0,15.2 = 2y + 0,6 (2)
Từ 1, 2 ⇒ x = 0,7 và y = 0,9
Ví dụ 2: Đốt cháy 11,2 gam bột Fe trong bình đựng O2 thu được 14,72 gam hỗn hợp X gồm Fe2O3, Fe3O4 và Fe. Hòa tan hoàn toàn lượng hỗn hợp X bằng dung dịch HNO3 thu được V lít hỗn hợp khí Y gồm NO và NO2. Tỉ khối của B so với H2 bằng 19. Thể tích V ở đktc là bao nhiêu?
Lời giải
MX = 19.2 = 38
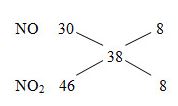
nN2= nNO2 = x
mFe + mO = moxit
⇒ mO = moxit – mFe = 14,72 – 11,2 = 3,52 gam
⇒ nO= 0,22 mol
Fe0 → Fe3+ + 3e
0,2 → 0,6
O0 + 2e →O2-
0,22 → 0,44
N+5 + 3e → N+2
3x x
N+5 +1e → N+4
x x
Bảo toàn e: 0,6 = 0,44 + 3x + x =0,44+4x ⇒ x= 0,04
⇒nkhí = 2x = 0,08 mol
⇒ Vkhí = 0,08.22,4 = 1,792 lít = 1792 ml
Ví dụ 3: Cho 30 gam hỗn hợp X gồm: Fe; FeO; Fe2O3 và Fe3O4 phản ứng hết với dung dịch HNO3 loãng dư được 5,6 lít khí NO (đktc, sp khử duy nhất) và dung dịch Y. Số mol của HNO3 đã phản ứng là bao nhiêu?
Lời giải
Quy đổi 30 gam hỗn hợp X thành Fe, và O. Gọi x, y lần lượt là số mol của Fe và O suy ra:
56x + 16y = 30 (1);
3x – 2y = 0,25.3 (2);
Từ 1, 2 ⇒ x = 0,45 và y = 0,3; nHNO3 = 4.nNO + 2nO = 4.0,25 + 2.0,3 = 1,6 mol
Ví dụ 4: Hòa tan hết m gam FeS bằng một lượng tối thiểu dung dịch HNO3 (dung dịch X), thu được dung dịch Y và khí NO. Dung dịch Y hòa tan tối đa 1,92 gam Cu. Biết trong các quá trình trên, sản phẩm khử duy nhất của N+5 đều là NO. Số mol HNO3 trong X là bao nhiêu?
Lời giải
nCu = 0,03 mol
Ta có: 2Fe3+ + Cu → 2Fe2+ + Cu2+
⇒ nFe3+(Y) =0,6 mol => nFeS = 0,6 mol
FeS → Fe3+ + S+6 + 9e
N+5 + 3e → N+2
⇒ Bảo toàn e: nNO =3.nFe3+ = 0,18 mol
Dung dịch Y chứa Fe2(SO4)3 và Fe(NO3)3
Bảo toàn nguyên tố S: nFe2(SO4)3 = 1⁄3.nFeS = 0,02 mol
Bảo toàn nguyên tố Fe và S :
nFeS = 2.nFe2(SO4)3 + nFe(NO3)3
⇒ nFe(NO3)3= 0,06 − 2.0,02 = 0,02 ⇒ nNO − 3nNO3− muối = 0,06 mol
Bảo toàn nguyên tố N: nHNO3 = nNO + nNO3− muối= 0,36 + 0,12 = 0,24 mol
Sau khi đọc xong bài viết của chúng tôi có thể giúp các bạn biết cân bằng và điều chế no2 ra hno3 để áp dụng vào làm bài tập rồi nhé. Hãy theo dõi chúng tôi để được chia sẻ kiến thức khác bổ ích nữa nhé